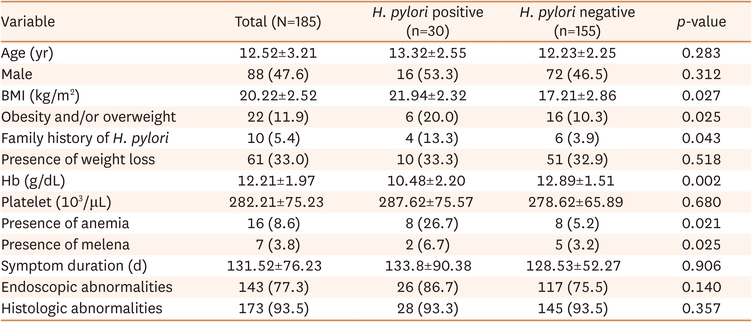
[fusion_builder_container type=»flex» hundred_percent=»no» hundred_percent_height=»no» hundred_percent_height_scroll=»no» align_content=»stretch» flex_align_items=»flex-start» flex_justify_content=»flex-start» hundred_percent_height_center_content=»yes» equal_height_columns=»no» container_tag=»div» hide_on_mobile=»small-visibility,medium-visibility,large-visibility» status=»published» border_style=»solid» box_shadow=»no» box_shadow_blur=»0″ box_shadow_spread=»0″ gradient_start_position=»0″ gradient_end_position=»100″ gradient_type=»linear» radial_direction=»center center» linear_angle=»180″ background_position=»center center» background_repeat=»no-repeat» fade=»no» background_parallax=»none» enable_mobile=»no» parallax_speed=»0.3″ background_blend_mode=»none» video_aspect_ratio=»16:9″ video_loop=»yes» video_mute=»yes» absolute=»off» absolute_devices=»small,medium,large» sticky=»off» sticky_devices=»small-visibility,medium-visibility,large-visibility» sticky_transition_offset=»0″ scroll_offset=»0″ animation_direction=»left» animation_speed=»0.3″ filter_hue=»0″ filter_saturation=»100″ filter_brightness=»100″ filter_contrast=»100″ filter_invert=»0″ filter_sepia=»0″ filter_opacity=»100″ filter_blur=»0″ filter_hue_hover=»0″ filter_saturation_hover=»100″ filter_brightness_hover=»100″ filter_contrast_hover=»100″ filter_invert_hover=»0″ filter_sepia_hover=»0″ filter_opacity_hover=»100″ filter_blur_hover=»0″][fusion_builder_row][fusion_builder_column type=»1_1″ layout=»1_1″ align_self=»auto» content_layout=»column» align_content=»flex-start» valign_content=»flex-start» content_wrap=»wrap» spacing=»» center_content=»no» link=»» target=»_self» min_height=»» hide_on_mobile=»small-visibility,medium-visibility,large-visibility» sticky_display=»normal,sticky» class=»» id=»» type_medium=»» type_small=»» order_medium=»0″ order_small=»0″ dimension_spacing_medium=»» dimension_spacing_small=»» dimension_spacing=»» dimension_margin_medium=»» dimension_margin_small=»» margin_top=»» margin_bottom=»» padding_medium=»» padding_small=»» padding_top=»» padding_right=»» padding_bottom=»» padding_left=»» hover_type=»none» border_sizes=»» border_color=»» border_style=»solid» border_radius=»» box_shadow=»no» dimension_box_shadow=»» box_shadow_blur=»0″ box_shadow_spread=»0″ box_shadow_color=»» box_shadow_style=»» background_type=»single» gradient_start_color=»» gradient_end_color=»» gradient_start_position=»0″ gradient_end_position=»100″ gradient_type=»linear» radial_direction=»center center» linear_angle=»180″ background_color=»» background_image=»» background_image_id=»» background_position=»left top» background_repeat=»no-repeat» background_blend_mode=»none» render_logics=»» filter_type=»regular» filter_hue=»0″ filter_saturation=»100″ filter_brightness=»100″ filter_contrast=»100″ filter_invert=»0″ filter_sepia=»0″ filter_opacity=»100″ filter_blur=»0″ filter_hue_hover=»0″ filter_saturation_hover=»100″ filter_brightness_hover=»100″ filter_contrast_hover=»100″ filter_invert_hover=»0″ filter_sepia_hover=»0″ filter_opacity_hover=»100″ filter_blur_hover=»0″ animation_type=»» animation_direction=»left» animation_speed=»0.3″ animation_offset=»» last=»true» border_position=»all» first=»true»][fusion_text columns=»» column_min_width=»» column_spacing=»» rule_style=»default» rule_size=»» rule_color=»» font_size=»» line_height=»» letter_spacing=»» text_color=»» content_alignment_medium=»» content_alignment_small=»» content_alignment=»» animation_type=»» animation_direction=»left» animation_speed=»0.3″ animation_offset=»» hide_on_mobile=»small-visibility,medium-visibility,large-visibility» sticky_display=»normal,sticky» class=»» id=»»] Importancia y factores relacionados de la infección por Helicobacter pylori en niños con dispepsia Significance and related factors of Helicobacter pylori infection in children with dyspepsia. Kim, Hyun Jin. “Significance and Related Factors of Helicobacter pylori Infection in Children with Dyspepsia.” Pediatric gastroenterology, hepatology & nutrition vol. 28,1 (2025): 38-45.[/fusion_text][fusion_imageframe image_id="7262|full" max_width="" sticky_max_width="" style_type="" blur="" stylecolor="" hover_type="none" bordersize="" bordercolor="" borderradius="" align_medium="none" align_small="none" align="center" lightbox="no" gallery_id="" lightbox_image="" lightbox_image_id="" alt="" link="" linktarget="_self" animation_type="" animation_direction="left" animation_speed="0.3" animation_offset="" hide_on_mobile="small-visibility,medium-visibility,large-visibility" sticky_display="normal,sticky" class="" id="" filter_hue="0" filter_saturation="100" filter_brightness="100" filter_contrast="100" filter_invert="0" filter_sepia="0" filter_opacity="100" filter_blur="0" filter_hue_hover="0" filter_saturation_hover="100" filter_brightness_hover="100" filter_contrast_hover="100" filter_invert_hover="0" filter_sepia_hover="0" filter_opacity_hover="100" filter_blur_hover="0"]https://colombia.isomed.com/wp-content/uploads/2025/02/feb1.jpg[/fusion_imageframe][fusion_text columns="" column_min_width="" column_spacing="" rule_style="default" rule_size="" rule_color="" font_size="" line_height="" letter_spacing="" text_color="" content_alignment_medium="" content_alignment_small="" content_alignment="" animation_type="" animation_direction="left" animation_speed="0.3" animation_offset="" hide_on_mobile="small-visibility,medium-visibility,large-visibility" sticky_display="normal,sticky" class="" id=""] Helicobacter pylori (H. pylori) es una bacteria que se asocia con la úlcera péptica y el cáncer gástrico. Sin embargo, faltan estudios sobre el hallazgo endoscópico y los factores relacionados con la infección por H. pylori en niños. Este estudio tuvo como objetivo evaluar la prevalencia y los factores asociados a la infección por H. pylori en niños con dispepsia. Tras evaluar la presencia y los factores vinculados a la infección por H. pylori en niños, este estudio muestra una prevalencia de infección del 16,2% en los pacientes con dispepsia y del 18,8% en los pacientes con úlcera péptica. También se ha encontrado una asociación significativa entre la infección por H. pylori y la presencia de obesidad, vinculando un mayor riesgo de infección por esta bacteria a los participantes con obesidad frente a los de menor peso. Una posible explicación radica en el papel de las hormonas gástricas. Los niveles de la grelina, que aumenta el apetito durante el hambre, y la leptina, que disminuye el apetito e induce la respuesta de saciedad, fueron más bajos en los individuos positivos para H. pylori que en los individuos con diagnóstico negativo. Otro posible factor puede ser una mayor resistencia a la insulina en pacientes con infección, que favorece el desarrollo de obesidad. Este estudio además avala que un niño con infección por H. pylori constituye un factor de riesgo para la transmisión de dicha bacteria a su familia y otros allegados (como los compañeros del niño en la escuela). Por lo tanto, detectar H. pylori y erradicarla en toda una familia es una estrategia de prevención y/o tratamiento recomendable, que también mejora la prevención de la recurrencia por reinfección entre los miembros de la misma familia o grupo social. Conclusión: La prevalencia de la infección por H. pylori fue baja en los niños con dispepsia. Sin embargo, los niños con obesidad o que tenían antecedentes familiares de infección por H. pylori tuvieron una mayor probabilidad de padecerla también, e incluso aquellos que se encontraban infectados mostraron un curso clínico más grave. ver artículo