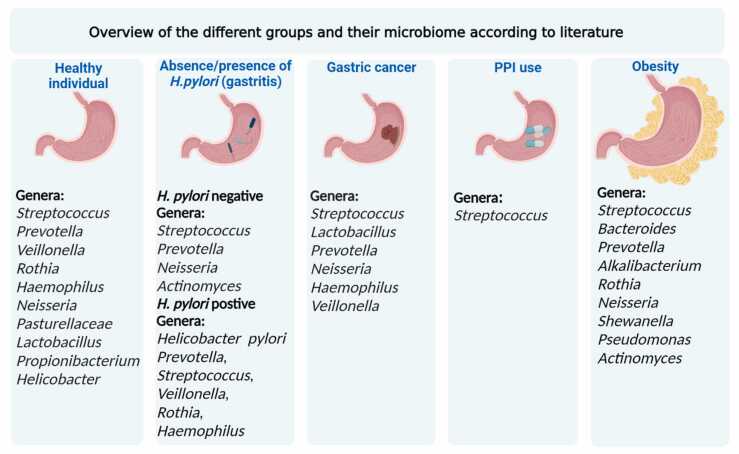
Dieta rica en crucíferas y control de Helicobacter pylori
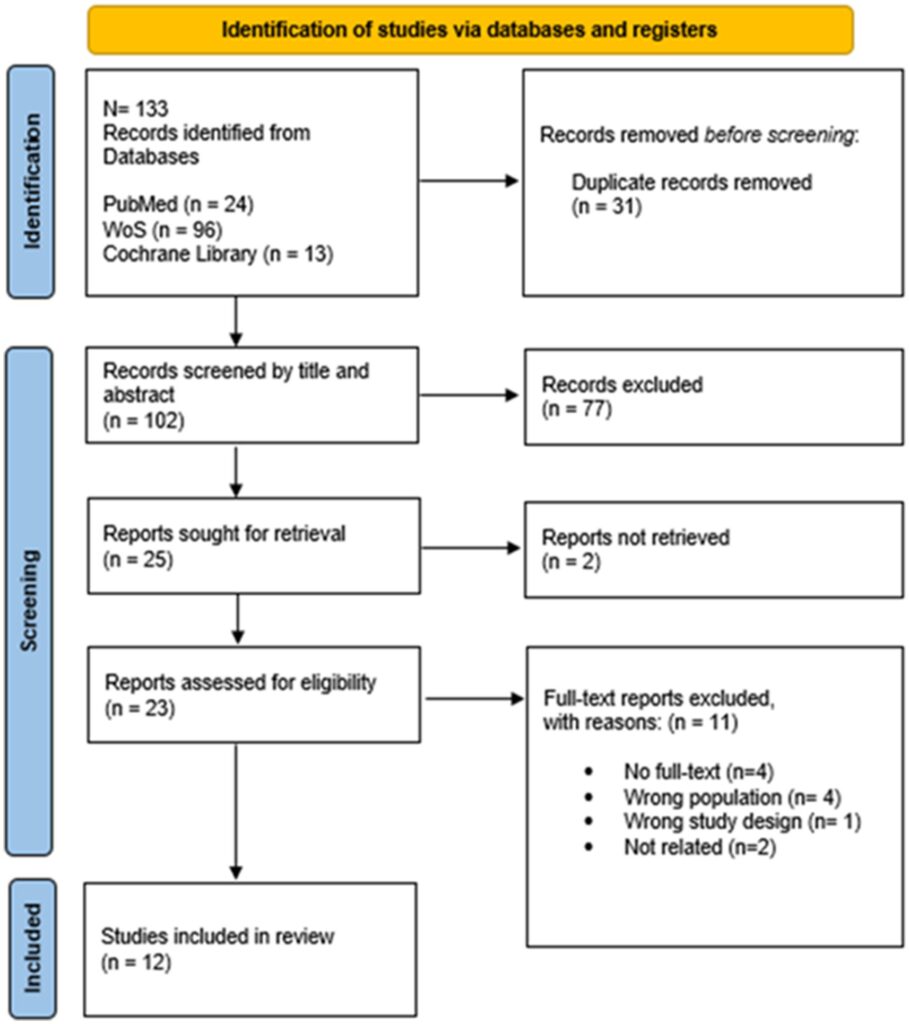
¿Una dieta rica en crucíferas puede favorecer el control de infección por Helicobacter pylori? Una revisión sistemática. Can a diet rich in Brassicaceae help control Helicobacter pyloriinfection? A systematic review. Properzi, Sara, et al. «Can a diet rich in Brassicaceae help control Helicobacter pylori infection? A systematic review.» Frontiers in Medicine 11 (2024): 1454902. Comienza a haber sólidas evidencias que avalan que los metabolitos derivados del consumo de Brassicaceae (crucíferas) podrían servir como terapia adyuvante para la infección por Helicobacter pylori, ofreciendo posibles beneficios antimicrobianos y antiinflamatorios. En esta revisión sistemática se analiza la evidencia científica existente que sugiere que el consumo de Brassicaceae (crucíferas) puede reducir la colonización por Helicobacter pylori (H. pylori). El grupo de las crucíferas se encuentra compuesto por alimentos como el brócoli, la coliflor, el repollo, la col…). Más allá de las tasas de erradicación, son notables los posibles efectos protectores del sulforafano, que se encuentra presente en este grupo de alimentos, contra el daño de la mucosa gástrica inducido por H. pylori. La evidencia científica presente en esta revisión reveló reducciones significativas en los niveles de NOx en todos los grupos de intervención. Los niveles elevados de NOx juegan un papel crítico en el desarrollo de la inflamación de la mucosa gástrica, gastritis y cáncer gástrico. La reducción más pronunciada se observó en un grupo que había recibido 6 g/día de polvo de brotes de brócoli durante 28 días solo o combinado con la terapia triple estándar. Estos hallazgos ponen de manifiesto el posible papel protector del sulforafano contra el daño oxidativo inducido por el H. pylori en la mucosa gástrica, mitigando la inflamación que subyace a la carcinogénesis. Otro dato de interés de esta revisión es que la administración de derivados de sulforafano o probióticos productores del mismo no alteró significativamente la incidencia de eventos adversos típicamente asociados con la terapia con antibióticos, como trastornos del gusto, diarrea, dolor de cabeza, dolor epigástrico, náuseas y urticaria. A pesar de los conocidos efectos anticancerígenos de los glucosinolatos, no se puede excluir que los extractos de Brassicaceae en dosis altas puedan tener efectos indeseables, como daño hepatocelular, irritación y aumento de la apoptosis en las células gástricas, especialmente a altas concentraciones. Esto pone de manifiesto la continua necesidad de realizar estudios para dilucidar los diversos efectos potenciales de estas moléculas en relación con sus concentraciones. ver artículo